لوزالمعده مصنوعی برای درمان قطعی دیابت ، امیدواری ها و موانع
در دهه اخیر بیماری دیابت به یکی از مشکلات فراگیر درمانی همه جوامع تبدیل شده است. شمار بالای مبتلایان به دیابت و روند رو به رشد آن ، رقابت شدیدی در مؤسسات تحقیقاتی در سراسر دنیا بر سر گسترش روش های درمانی ایجاد کرده است. به ویژه وقتی هزینه پیشگیری و درمان دیابت و عوارض آن سالانه در سراسر دنیا بالغ بر 376 میلیارد دلار می شود که بازار عمده ای محسوب می شود.
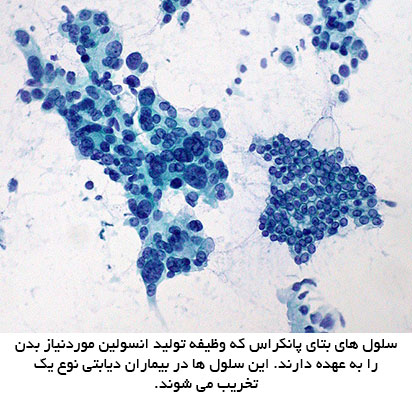 دیابت ملیتوس که توسط ارسطو دانشمند یونانی (81-138 پس از میلاد) نامگذاری شده بود ، در حدود 1500 سال پیش از میلاد شناخته و تشخیص داده شده بود.
دیابت ملیتوس که توسط ارسطو دانشمند یونانی (81-138 پس از میلاد) نامگذاری شده بود ، در حدود 1500 سال پیش از میلاد شناخته و تشخیص داده شده بود.
با این وجود زمان زیادی نیست که با کشف انسولین به وسیله بانتینگ و بست در 1921 ، درمان این بیماری ممکن شده است. در حال حاضر حدود 20 میلیون نفر در ایالت متحده از این بیماری رنج می برند. در هر زمان حدود 15-35% همه بیماران بزرگسال برای درمان دیابت تحت درمان با تزریقات روزانه انسولین به همراه مراقبت های کلینیکی قرار می گیرند.
 بدیهی است که با توجه به عوارض شدید کوتاه مدت و بلندمدت دیابت و همچنین شمار رو به گسترش مبتلایان در جای جای جهان ، لزوم بازنگری در روند درمانی فعلی ضروری به نظر می رسد. خصوصاً وقتی بدانیم با وجود همه پیشرفت ها ، از ساخت سنسورها و دستگاههای اندازه گیری گرفته تا انسولین هایی که با عملکردی نزدیک به سرعت متابولیسم طبیعی قند در بدن افراد سالم تولید شده اند ، کماکان پایه و اساس درمان های فعلی به دهه 1920 بر می گردد. شیوه ای غیر هوشمندانه و بدون فیدبک پیوسته و مقبول که مبتنی بر تزریق های مداوم زیر پوستی انسولین به بدن بیمار است.
بدیهی است که با توجه به عوارض شدید کوتاه مدت و بلندمدت دیابت و همچنین شمار رو به گسترش مبتلایان در جای جای جهان ، لزوم بازنگری در روند درمانی فعلی ضروری به نظر می رسد. خصوصاً وقتی بدانیم با وجود همه پیشرفت ها ، از ساخت سنسورها و دستگاههای اندازه گیری گرفته تا انسولین هایی که با عملکردی نزدیک به سرعت متابولیسم طبیعی قند در بدن افراد سالم تولید شده اند ، کماکان پایه و اساس درمان های فعلی به دهه 1920 بر می گردد. شیوه ای غیر هوشمندانه و بدون فیدبک پیوسته و مقبول که مبتنی بر تزریق های مداوم زیر پوستی انسولین به بدن بیمار است.
 آنچه موجب عوارض بلندمدت بیماری دیابت است ، در حقیقت بالا بودن قند خون به مدت طولانی و همین طور نوسانات زیاد قند خون در بیمار است. پـس هدف اصلی در هر روش درمانی برای دیابت ، نگهداشتن قند خون در این محدوده است. شمار مبتلایان به دیابت روز به روز در حال افزایش است. این مسأله پژوهشگران را بر آن داشته است که به عنوان مشکلی فراگیر برای بهبود زندگی مبتلایان تلاش کنند.
آنچه موجب عوارض بلندمدت بیماری دیابت است ، در حقیقت بالا بودن قند خون به مدت طولانی و همین طور نوسانات زیاد قند خون در بیمار است. پـس هدف اصلی در هر روش درمانی برای دیابت ، نگهداشتن قند خون در این محدوده است. شمار مبتلایان به دیابت روز به روز در حال افزایش است. این مسأله پژوهشگران را بر آن داشته است که به عنوان مشکلی فراگیر برای بهبود زندگی مبتلایان تلاش کنند.

ساختار متابولیسم قند خون و هورمون های مربوطه
پس از صرف غذا ، کربوهیدرات های قندی جذب شده که شامل مواد نشاسته ای ، شیرینی ها ، نان ، و ... است ، قند خون را بالا می برد. مواد پروتئینی و چربی ها تأثیر مستقیمی روی قندخون ندارند. لوزالمعده انسان سالم در پاسخ به بالارفتن قندخون ، انسولین ترشح می کند. انسولین ، قند را در سلول وارد کرده و به مصرف می رساند و قند مازاد را به چربی تبدیل می کند که ذخیره می شود. همینطور در تبدیل قند آزاد به قند ذخیره شده در ماهیچه یا کبد که گلیکوژن نام دارد ، انسولین نقش اساسی دارد.
با گذشت زمان ، صرف غذا و انجام فعالیت و عوامل دیگر ، قند خون کاهش می یابد. در این زمان لوزالمعده با ترشح هورمون گلوکاگون گلیکوژن یا قندهای ذخیره شده را آزاد می کند تا قند خون بالا برود. شکل زیر این روند را توضیح داده است.
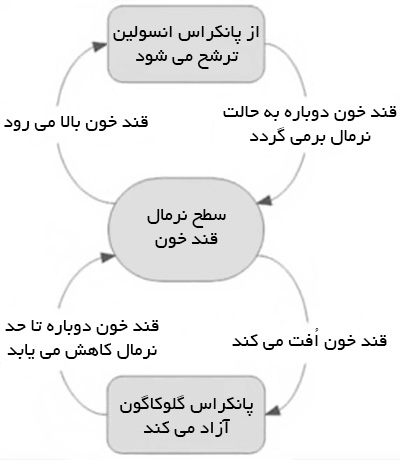
بخش بالایی نمودار در بیماران دیابتی نوع 1 کاملا متوقف می شود و در بیماران نوع 2 هم پس از مدتی از ابتلا با تقریب قابل قبولی می توان از کار افتاده در نظر گرفت.
نیمه پایینی نمودار نمایانگر وضعیت افت قندخون و پاسخ لوزالمعده به آن است.
سطوح قند خون پایین بسیار پر مخاطره است و میتواند به از دست دادن آگاهی ، هوشیاری و سپس مرگ منجر شود.
وظیفه این بخش از سیستم تنظیم قند خون پانکراس ، مقابله با این خطر از طریق آزادسازی هورمون گلوکاگون است. گلوکاگون به کبد می رود و در آنجا در صورت وجود ذخایر کافی ، کبد قند آزاد می کند.
این مکانیسم در بدن افراد دیابتی هم به خوبی عمل می کند ؛ اگر چه پس از مدتی به دلیل افت قندهای مکرر ضعیف شده و آستانه ترشح گلوکاگون پایین تر می رود.
با صرف غذا قند خون افزایش یافته و ترشح انسولین ، قند را به مصرف سلول می رساند.
توضیح آنکه جهت فعالیت طبیعی مغز لازم است قند خون بالاتر از 55 mg/dl باشد ، حتی در غیاب انسولین.

روند کار در یک لوزالمعده مصنوعی
1- جریان خون به حسگر گلوکز نفوذ پیدا می کند ،
2- حسگر میزان قند خون را محاسبه کرده و مقدار انسولین محاسبه شده توسط کنترلر را به پمپ انتقال می دهد.
3- پمپ انسولین میزان انسولین را به طور دقیق وارد بدن می کند.
متأسفانه از میان 3 جزء یاد شده تنها پمپ انسولین است که کاملا بی عیب و نقص کار می کند و مدلهای متنوعی از آن قریب 25 سال است که در بازار موجود است.
استفاده فعلی پمپ تقریباً محدود به سیستم حلقه باز تزریق انسولین است و تنها فیدبکی از بیمار به طور دستی دریافت میکند. اطلاعات بیمار برای بستن حلقه فیدبک محدود به آزمایشهای گسسته چند ساعت یکبار و شماری اطلاعات پزشک معالج است. یعنی پسخورد با خطای بسیار بالا بسته می شود. در پمپ های تزویج شده با سنسور این نقص کمتر به چشم می خورد.
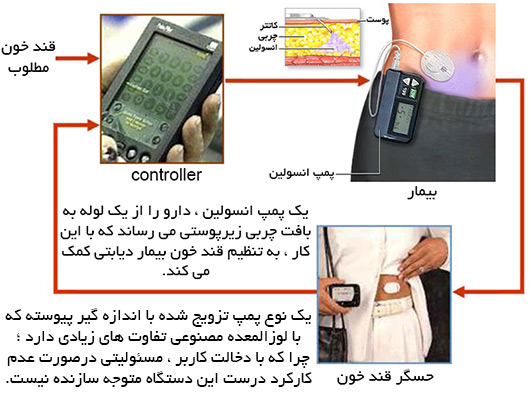
سیستم نوین درمانی دیابت با تلفن همراه
این سامانه از طریق بلوتوث به تلفن همراه بیمار مرتبط می شود تا بتواند پزشک یا تیم درمانی را لحظه به لحظه در جریان قند خون بیمار گذاشته ، بخصوص در مواقع بحرانی افت شدید قند با فرستادن هشدارهای لازم ، نزدیکان یا درمانگر بیمار را آگاه می سازد.
در ارتباط با یکی کردن نمایشگر سامانه های اندازه گیر قندخون با تلفن همراه هم قرار است بهزودی تلفن ها هم مجهز به نرم افزار کاربردی مربوطه شود و با حسگر بلوتوث مرتبط شود.
در واقع این سیستم یک لوزالمعده مصنوعی به شمار می رود که کنترل کننده آن تمام اتوماتیک و کامپیوتری نیست بلکه از پزشک دستور می گیرد.
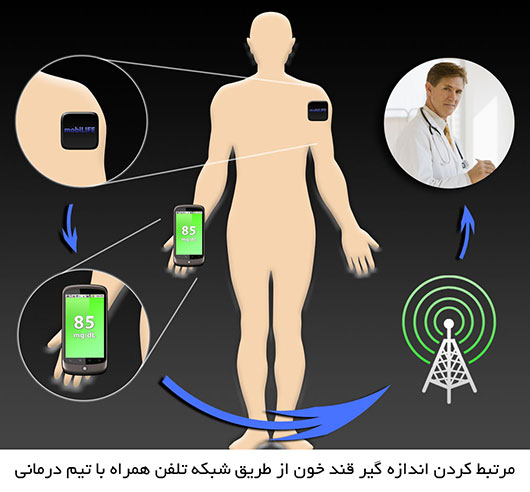
مسأله نظری اساسی: تطابق یک وسیله الکترونیکی با بدن انسان!
شکل زیر به زیبایی سیستم حلقه بسته پانکراس مصنوعی را به 2 بخش طبیعی (راست) و مصنوعی (چپ) تقسیم کرده است. اصولا ساخت یک ابزار هوشمند الکترونیکی که بتواند در تعامل پویا با بدن انسان که شامل میلیاردها سلول زنده است باشد ، بسیار مشکل به نظر می رسد.
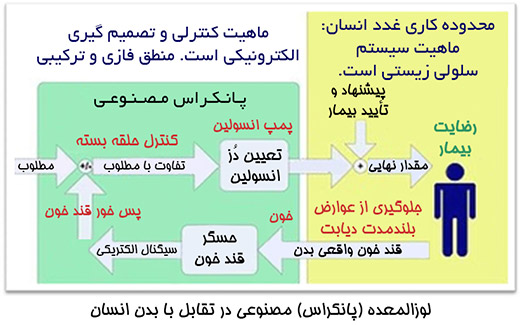 لوزالمعده مصنوعی فن آوری در حال پیشرفتی برای درمان بیماران دیابتی است تا سطح قند خون آنها را با شبیه سازی رفتار یک لوزالمعده سالم ، به طور خودکار کنترل کند. لوزالمعده وظایف متفاوتی از جمله ترشحات گوارشی و همچنین ترشحات هورمونی دارد اما مشکل اصلی در بیماران دیابتی ، نبود هورمون انسولین است و لوزالمعده مصنوعی قرار است که این کار را به خوبی انجام دهد. درمانهای فعلی مبتنی بر تزریق انسولین از این جهت که ادامه زندگی را در بیمار ممکن میسازد ، بسیار خوب به نظر میرسد اما تنظیم قند خون در محدوده نرمال صرفاً با تزریق انسولین کار بسیار سختی است که به این راحتیها برای همه بیماران جواب نمیدهد. درصورت استفاده از لوزالمعده مصنوعی و دستیابی به کنترل دقیقتر قندخون ، بسیاری از عوارض کلیوی ، چشمی ، قلبی عروقی ، سکته و مرگ ناشی از بالا بودن طولانی مدت قندخون در مبتلایان به دیابت به وجود نمیآید.
لوزالمعده مصنوعی فن آوری در حال پیشرفتی برای درمان بیماران دیابتی است تا سطح قند خون آنها را با شبیه سازی رفتار یک لوزالمعده سالم ، به طور خودکار کنترل کند. لوزالمعده وظایف متفاوتی از جمله ترشحات گوارشی و همچنین ترشحات هورمونی دارد اما مشکل اصلی در بیماران دیابتی ، نبود هورمون انسولین است و لوزالمعده مصنوعی قرار است که این کار را به خوبی انجام دهد. درمانهای فعلی مبتنی بر تزریق انسولین از این جهت که ادامه زندگی را در بیمار ممکن میسازد ، بسیار خوب به نظر میرسد اما تنظیم قند خون در محدوده نرمال صرفاً با تزریق انسولین کار بسیار سختی است که به این راحتیها برای همه بیماران جواب نمیدهد. درصورت استفاده از لوزالمعده مصنوعی و دستیابی به کنترل دقیقتر قندخون ، بسیاری از عوارض کلیوی ، چشمی ، قلبی عروقی ، سکته و مرگ ناشی از بالا بودن طولانی مدت قندخون در مبتلایان به دیابت به وجود نمیآید.
پانکراس مصنوعی در واقع باید با پیش فرض ها و همچنین اطلاعات گرفته شده از حسگر و بیمار الگوریتم قدرتمندی جهت نزدیک شدن به هدف ایده آل داشته باشد. یعنی کنترل سختگیرانه دیابت را بدون دخالت انسانی انجام دهد.
مهم تر اینکه به فرض در اختیار داشتن سیگنال قند خون با خطای قابل چشم پوشی و نزدیک به حد واقعی ، هنوز متأسفانه الگوریتم کاملی که بتواند با گرفتن قند خون لحظه ای عملکرد لوزالمعده را بازسازی کند ، ارائه نشده و الگوریتمهای فعلی با وجود گذشت بیش از 40 سال از اولین مدل های ارائه شده تاکنون عملکرد بدون نقصی نداشته اند. علت این موضوع ، پیچیدگی فوق العاده بدن انسان و زیاد بودن متغیرهای ورودی هستند. متغیرهایی که بیشتر آنها قابل اندازه گیری هم نیستند!
یعنی طراحی یک الگوریتم یا همان کنترلگر مناسب ، همان طور که اشاره شد سال هاست مقاله ها و تحقیقات زیادی را در حوزه مهندسی کنترل به خود اختصاص داده و هم اکنون با توجه به پیشرفت های تکنیکی بیشتر در سایر قطعات لوزالمعده مصنوعی مانند سنسور و واردکننده خودکار انسولین به بدن (پمپ) زمینه بسیار متداولی است. به نوعی بخش های دیگری منتظر اتمام و به نتیجه رسیدن طرح کنترلر مورد نظر هستند و این توقع به وجود آمده که نهایتاً تا سال 2015 اولین مدل های آزمایش شده روی انسان وارد بازار شود. بطور کلی با صرف غذا قند خون افزایش یافته ، ترشح انسولین قند را به مصرف سلول می رساند. توضیح آنکه جهت فعالیت طبیعی مغز لازم است قند خون بالاتر از 55 mg/dl باشد ، حتی در غیاب انسولین. سلول های عصبی تنها سلول هایی هستند که به طور مستقیم گلوکز را از خون برداشت می کنند و نیازی به انسولین ندارند. از طرفی بر خلاف سایر سلول ها ، توانایی استفاده از چربی و پروتئین را هم ندارند. پس همواره باید این میزان حداقل قند در خون باشد.
در اینجا مشکلات مربوط به توسعه الگوی اولیه روش های کنترلی برای لوزالمعده مصنوعی را بررسی می کنیم. چنین سیستمی حداقل این 5 مشکل را بایستی پشت سر بگذارد:
1- مسأله پویایی انسولین/گلوکز یا همان رابطه و نموداری که تغییرات قند خون را نسبت به میزان انسولین ورودی برای هر بیمار نشان دهد. این سینماتیک ذاتاً غیرخطی بوده و تاکنون به میزان کمی جهت رسیدن به یک عملکرد مطلوب مدلسازی شده است.
2- مسأله در نظر گرفتن و حس کردن اغتشاشات بیرونی که در توانایی و سلطه سیستم کنترلی قرار ندارد. (اغتشاش بیرونی از قبیل غذایی که بیمار می خورد و یا فعالیت های بدنی بیمار دیابتی)
3- مسأله سیستم های پویایی که توانایی محدود و مشخصی در رساندن انسولین با شار زمانی متفاوت دارند و به نوعی سلطه ایده آلی در رساندن مقادیر دیکته شده از کنترلر به بدن ندارند و ممکن است به عملکرد نامطمئنی برسند.
این مسأله امروزه تا حد زیادی رفع شده و دیگر به عنوان مشکل اساسی مطرح نمیشود. در عین حال در مسائل کنترلی مورد توجه ماست.
4- عملکرد مطلوب و مطمئن سیستم های پویا مستلزم این است که متغیرهای حالت سیستم در یک محدوده کاری خاص تجویزشده نگهداشته شود.
5- پیچیدگی و غیرخطی بودن سیستم متابولیسم قندخون در بدن انسان آنچنان زیاد است که پارامترهایش نه تنها از فردی به فرد دیگر ، بلکه در یک فرد و در زمانهای متفاوت تغییر می کند. باید تلاش شود سیستم طوری طراحی شود که ویژگی های منحصر به فرد هرکس را پس از مدتی و به صورت آنلاین بیاموزد.
به عنوان مثال در بعضی بیماران مقاومت به انسولین در ساعات خاصی بیشتر است که باید این ساعات به همراه شدت آن مشخص شود.
در ساخت لوزالمعده مصنوعی از اندازه گیر قندخون پیوسته استفاده می شود که به طور مداوم قندخون بیمار را اندازه می گیرد.
امروزه به بیماران توصیه می شود از این اندازه گیرها استفاده کنند ، کما اینکه این دستگاهها در بسیاری از کشورها متداول شده و بسیاری بیماران حتی بدون داشتن پمپ انسولین ، یک دستگاه اندازه گیر پیوسته قندخون را به خود متصل می کنند تا در جریان لحظه به لحظه قندخون خود قرار گیرند و اقدامات لازم را به سرعت انجام دهند. این دستگاهها مزایای زیادی دارد ؛ از جمله اینکه با کاهش یا افزایش خطرناک قندخون ، هشدار می دهند. اما هنوز دقت آنها به گلوکومتر های متداول گسسته نرسیده و مرتباً باید با یک دستگاه گلوکومتر چک و تنظیم شود.
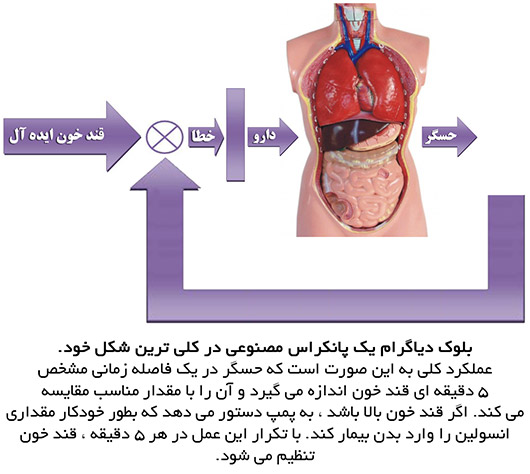
اولین لوزالمعده مصنوعی
بایو استار اولین سیستم لوزالمعده مصنوعی بود که در دهه 1980 توسعه داده شد. متأسفانه اطلاعات ناقصی در مورد اطمینان و تأثیر این دستگاه در مدارک پزشکی مربوطه ارائه شده است. هدف از ساخت این دستگاه استفاده در محیط کلینیکی با نظارت مستقیم پزشک مربوطه بود و اساساً در تحقیقات استفاده شد و عملا به ندرت استفاده بیمارستانی پیدا کرد. بایو استار در فواصل زمانی منظم قند خون را اندازه می گرفت و با محاسبه مقدار انسولین مناسب ، آن را به بیمار تزریق می کرد. برای جلوگیری از افت قندخون ، توانایی تزریق مقداری گلوکز به بدن بیمار داشت.

مهمترین آزمایش درحال انجام از لوزالمعده مصنوعی
انجمن دیابت جوانان امریکا که در رأس پروژه ساخت لوزالمعده مصنوعی است ، مجموعه آزمایشاتی انجام داده است که در مرحله بعدی و در تابستان 2013 قرار است دستگاه ساخته شده را روی حدود 40 کودک دیابتی نوع یک و در یک کمپ ویژه آزمایش کند. دلیل انجام آزمایش روی کودکان احتمالا این است که بدن این بیماران مدت کمتری در ارتباط با دیابت بوده و مدل شناخته شده تری دارد ؛ در حالی که در اغلب بیماران که به مدت طولانی مبتلا بوده اند ، به علت افت قندهای مکرر مکانیسم ترشح گلوکاگون مختل شـده و یا تاحدودی مقاومت به انسولین وجود دارد که بدن این افراد نیاز به دستگاه پیچیدهتری از نظر نرم افزاری دارد.
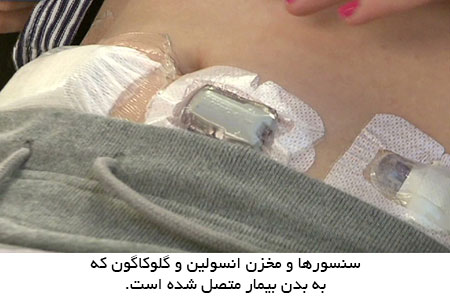 در آخرین آزمایش انجام شده توسط همین گروه در اردیبهشت 1391 ، این دستگاه که یک لوزالمعده مصنوعی خارج بدنی است ، سه روز متوالی به بدن بیمار متصل شد. تفاوت اصلی با آزمایش های قبلی که در بیمارستان انجام می شد ، استفاده آن در محیط خارج بیمارستانی و در منزل است که پیشرفت بزرگی به شمار می رود.
در آخرین آزمایش انجام شده توسط همین گروه در اردیبهشت 1391 ، این دستگاه که یک لوزالمعده مصنوعی خارج بدنی است ، سه روز متوالی به بدن بیمار متصل شد. تفاوت اصلی با آزمایش های قبلی که در بیمارستان انجام می شد ، استفاده آن در محیط خارج بیمارستانی و در منزل است که پیشرفت بزرگی به شمار می رود.
بیمار که یک دختر 12 ساله بود گفت که برای اولین بار پس از تشخیص دیابت ، احساس کردم دیگر نگران نیستم و مجبور نیستم در شب هر سه ساعت بیدار شوم که با چک کردن قندخون اقدام لازم را انجام دهم.
مادر این کودک خبر انجام تحقیقات برای ساخت لوزالمعده مصنوعی را که بطور اتفاقی شنیده بود ، زمانی که دختر 8 ساله اش "الی" به دیابت مبتلا شد به او گفت. از این زمان بود که اصرار زیادی به مادرش می کرد که او را به عنوان داوطلب انجام آزمایش معرفی کند. "الی" بطور جدی موضوع را پیگیری می کرد و از مادرش می خواست که برای پیگیری تماس بگیرد.
 شرکت های مهندسی پزشکی رقابت شدیدی دارند که اولین سازنده لوزالمعده مصنوعی باشند.
شرکت های مهندسی پزشکی رقابت شدیدی دارند که اولین سازنده لوزالمعده مصنوعی باشند.
مدیر این طرح در انجمن دیابت جوانان ایالات متحده می گوید که خیلی امیدوار است که این دستگاه تا چهارسال آینده به بازار بیاید.
"الی" برای شروع آزمایش به بیمارستان عمومی ماساچوست رفت. پزشکان برای نصب یک لوزالمعده مصنوعی پارامترهای مخصوص او را ارزیابی کردند. "الی" می گوید که آرزو دارد برای یک روز هم شده بتواند این دستگاه را در منزل داشته باشد.
در آینده قرار است این دستگاه به اندازه یک تلفن همراه باشد و حتی می تواند قابل کاشت در بدن باشد اما درحال حاضر به یک کامپیوتر متصل است ؛ چرا که نرم افزار کنترل کننده که مغز متفکر یک پانکراس مصتوعی است ، حجم بسیار سنگینی دارد.
برای سه روز این دستگاه کار لوزالمعده را برای "الی" انجام داد ؛ طوری که استیون راشل استاد دانشگاه پزشکی هاروارد گفت: نتایجی که از این آزمایش مشاهده کردیم بسیار ما را شگفتزده کرد ، واقعاً درخشان بود.
یکی از اساتید دانشکده مهندسی پزشکی دانشگاه بوستون توضیح داد که این دستگاه الگوی تغییرات قندخون "الی" را فراگرفت و تغییرات را با توجه به آن هر پنج دقیقه اعمال میکرد.
"الی" در این آزمایش رژیم غذایی خاصی هم نداشت و میتوانست به اندازه میلش صرف کند ، کاری که در چهارسال گذشته نمی توانست انجام دهد. او بطور معمول در هر وعده غذایی حدود 45 گرم کربوهیدرات مصرف می کرد ، حال آنکه در این آزمایش 67 تا 100 گرم کربوهیدرات درهر وعده غذایی مصرف کرد.
اصولا هدف ایده آل برای یک لوزالمعده مصنوعی هم همین است که فرد زندگی عادی داشته باشد و هیچ رژیم غذایی هم درنظر نگیرد.
به نظر می رسد ساخت این دستگاه انقلاب بزرگی در درمان دیابت باشد.
الگوریتم یا نرم افزار کنترل کننده مشخص می کند که چه مقدار انسولین یا گلوکاگون در هر لحظه لازم است به بدن وارد شود و بنابراین دستوری را به پمپ تزریق کننده میفرستد.
در تمامی موارد بالا ، منظور لوزالمعده مصنوعی با نصب تجهیزات خارج بدن بیمار است و نوع قابل کاشت آن پیچیدگی های بیشتری دارد که افق طولانی تری برای نتیجه گیری به همراه دارد.
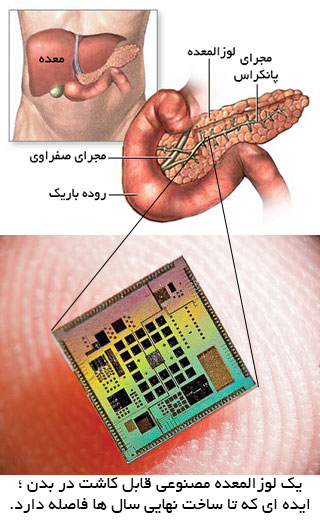
دستگاه انسولین هوشمند شیمیایی یا مخزن انسولین خودکار قابل کاشت در بدن
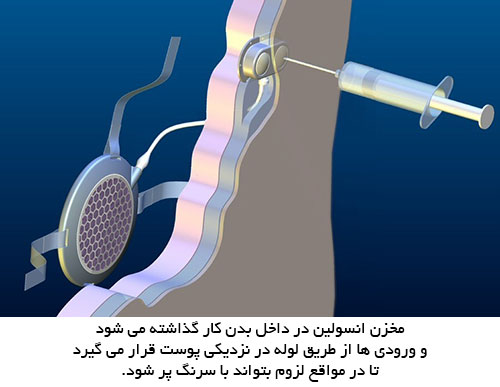
این وسیله توسط پروفسور تیلور در یکی از دانشگاه های انگلستان در حال توسعه است و برخلاف لوزالمعده مصنوعی که به آن اشاره شد ، حسگر و پمپ تزریق الکترونیکی ندارد. یک ابزار قابل کاشت در بدن انسان که بین پایین ترین دنده و مفصل ران کار گذاشته می شود و هر چند هفته باید مخزن انسولین آن پر شود.
این لوزالمعده مصنوعی شیمیایی از یک پوشش فلزی ساخته شده است که محتوی یک منبع انسولین است که با مانعی ژل مانند محافظت می شود و درحال حاضر مراحل آزمایشات پیش کلینیکی را طی می کند.
وقتی سطح قندخون بالا می رود ، مانع ژل مانند شروع به آب شدن می کند. در نتیجه انسولین می تواند خارج شود که به رگهای اطراف روده و از آنجا به رگ کبدی می ریزد.

انسولین واردشده قندخون را پایین می آورد و آنگاه مایع دوباره حالت ژل مانند به خود می گیرد که مانع از ورود انسولین بیشتر به بدن می شود. بدین ترتیب از افت قند هم جلوگیری می شود و وضعیت قندخون بیمار حالت طبیعی به خود می گیرد. بیمار از کنترل شخصی قندخون و تزریق بی نیاز می شود و از عوارض کلیوی ، چشمی و ... دیابت هم جلوگیری می شود.
 اگر این مخزن ترشح کننده انسولین موفقیت نهایی کسب کرده و بی خطر بودن آن هم به اثبات برسد ، راه حل ساده و نسبتاً کم هزینه ای برای درمان دیابت خواهد بود. سازنده آن امیدوار است که برای انجام آزمایش های کلینیکی هم آماده شود. با یک دید خوشبینانه چیزی حدود ده سال زمان لازم است که این ابزار به بازار وارد شود. مسائل پیچیده ای وجود دارد که در راه تأیید و آزمایش به وجود می آید. رها شدن مقدار انسولین بیشتری به هر علت مثلا تغییرات شیمیایی خون و ... می تواند خطر مرگ را به همراه داشته باشد.
اگر این مخزن ترشح کننده انسولین موفقیت نهایی کسب کرده و بی خطر بودن آن هم به اثبات برسد ، راه حل ساده و نسبتاً کم هزینه ای برای درمان دیابت خواهد بود. سازنده آن امیدوار است که برای انجام آزمایش های کلینیکی هم آماده شود. با یک دید خوشبینانه چیزی حدود ده سال زمان لازم است که این ابزار به بازار وارد شود. مسائل پیچیده ای وجود دارد که در راه تأیید و آزمایش به وجود می آید. رها شدن مقدار انسولین بیشتری به هر علت مثلا تغییرات شیمیایی خون و ... می تواند خطر مرگ را به همراه داشته باشد.
 از آن گذشته نیاز به مطالعات زیادی است تا مشخص شود این ژل تا چه مدت درست کار می کند و احتمال بروز حساسیـت هم هست. در عین حال اگر بهطور موفقیت آمیز روی یک بیمار آزمایش شود ، بعید است همان نمونه از این دستگاه بتواند روی همه بیماران دیابتی درست کار کند ؛ چرا که در یک قندخون یکسان مقادیر متفاوتی از انسولین در بیماران متفاوت باید آزاد شود تا قند را به حالت نرمال بازگرداند. حتی در یک فرد هم تحت تأثیر عوامل ساده ای مانند مقداری تحرک یا یک سرماخوردگی ، حساسیت به انسولین تغییر میکند و این ژل باید بتواند بطور هوشمند در این مواقع مقادیر کمتر یا بیشتری انسولین آزاد کند. سازنده معتقد است می تواند یک پروتئین خاصی را برای ساخت ژلی که میتواند به قند واکنش دهد ، استفاده کند.
از آن گذشته نیاز به مطالعات زیادی است تا مشخص شود این ژل تا چه مدت درست کار می کند و احتمال بروز حساسیـت هم هست. در عین حال اگر بهطور موفقیت آمیز روی یک بیمار آزمایش شود ، بعید است همان نمونه از این دستگاه بتواند روی همه بیماران دیابتی درست کار کند ؛ چرا که در یک قندخون یکسان مقادیر متفاوتی از انسولین در بیماران متفاوت باید آزاد شود تا قند را به حالت نرمال بازگرداند. حتی در یک فرد هم تحت تأثیر عوامل ساده ای مانند مقداری تحرک یا یک سرماخوردگی ، حساسیت به انسولین تغییر میکند و این ژل باید بتواند بطور هوشمند در این مواقع مقادیر کمتر یا بیشتری انسولین آزاد کند. سازنده معتقد است می تواند یک پروتئین خاصی را برای ساخت ژلی که میتواند به قند واکنش دهد ، استفاده کند.
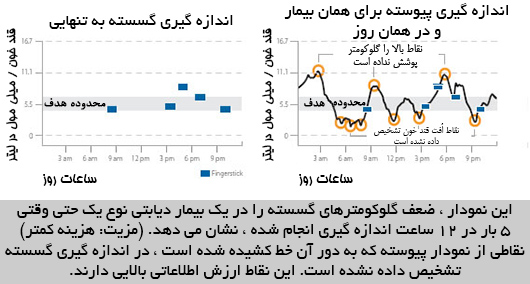
منبع: ماهنامه مهندسی پزشکی
کلمات کلیدی: biomedical engineering ، مهندسی پزشکی ، آشنایی با مهندسی پزشکی ، معرفی مهندسی پزشکی ، مهندسی پزشکی گرایش بالینی ، مهندسی پزشکی گرایش بیومکانیک ، مهندسی پزشکی گرایش بیوالکتریک ، مهندسی پزشکی گرایش بیومتریال (بیومواد) ، مهندسی پزشکی ایران ، مهندسی پزشکی دانشگاه پیام نور ، پایگاه آموزشی و اطلاع رسانی مهندسی پزشکی ، اخبار و تازه های مهندسی پزشکی ، مقالات مهندسی پزشکی ، آموزش مهندسی پزشکی ، دانلود کتاب های مهندسی پزشکی ، دانلود جزوه های مهندسی پزشکی ، دانلود نمونه سوالات امتحانی مهندسی پزشکی ، دیابت ، لوزالمعده ، لوزالمعده مصنوعی ، قند خون ، پانکراس


.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)