تفاوتهای سایبرنایف با گامانایف (بخش سوم)
تکنولوژی روباتیک سایبرنایف دارای مزیتهای بسیاری در مقایسه با گامانایف است. تفاوت اصلی و اساسی این دو سیستم در تولید نوع و روش تابیدن اشعه است. گامانایف اشعه های تولیدی را از طول عمر کبالت میسازد و اشعه تولیدی در سایبرنایف از جنس اشعه ایکس است. همچنین گامانایف دارای چند منبع تولید است در حالی که سایبرنایف تنها با استفاده از یک شتاب دهنده خطی اشعه را به صورت دقیق تر و تیزتری به تومور سرطانی میتاباند.

چند تفاوت اصلی سایبرنایف و گامانایف
1. گـامـانـایـف بـه طور انحصاری برای درمان تومورهای مغزی استفاده میشود که غیرقابل جراحی اند ؛ در حالی که تکنولوژی سایبرنایف تنها محدود به درمان تومورهای مغزی نمی شود و برای درمان توده های سرطانی در کل بدن و حتی قسمت های متحرک بدن (مثلا سرطان ریه که با تنفس عادی در حال حرکت است) کاربرد دارد.
2. در حالی که گامانایف برای تابش اشعه از 201 منبع کبالت استفاده میکند ، سایبرنایف تنها با استفاده از یک پرتو انرژی فوتون ، انرژی را به بازوی روباتیک خود منتقل میکند (یک منبع شتاب دهنده خطی). اشعه ایکس چند مگاولتی سایبرنایف چهار برابر قوی تر از انرژی کبالت مورد استفاده در گامانایف است.
3. سیستم گامانایف یک سیستم وابسته به فرم خاصی است ؛ در حالی که سایبرنایف یـک سیستـم انعطاف پذیر است. یعنی در سیستم سایبرنایف با یک یا در صورت نیاز چند جلسه درمان انجام میگیرد که اجازه میدهد تا ایمنی بیمار را بیشتر در نظر گرفته ، میزان دز اشعه را با توجه به شرایط بیمار تغییر دهد.
4. در درمان با سایبرنایف نیازی به پیچ کردن قالب سر (برای ثابت نگهداشتن سر) بر روی پیشانی نیست. به همین دلیل در طول درمان بیمار سردرد ، آسیب دیدگی پیشانی ، حالت تهوع و خطر عفونت در محل پیچ شده نخواهد داشت. در گامانایف قالب سر حتماً باید نصب شود.
5. به دلیل اندازه کوچک کولیماتورهای درون گامانایف ، امکان آسیب بافت های حیاتی در طول تابش اشعه وجود خواهد داشت و همچنین اندازه کوچک کولیماتورها محدوده درمانی توده های کمتر از 3 تا 4 سانتی متر را برای گامانایف ایجاد میکند و تومورهای بزرگتر توسط این روش قابل درمان نیستند. در حالی که در سایبرنایف به دلیل دقت بالای دستگاه و تابش اشعه به صورت بسیار تیز ، بافت های حیاتی آسیب نخواهد دید و محدودیتی در اندازه توده برای درمان نخواهد داشت.
6. تکنولوژی سایبرنایف حداقل چهل سال جدیدتر از تکنولوژی گامانایف است.
پت سی تی اسکن (PET/CT)
روشی نوین است که در علوم تشخیصی در فیزیک پزشکی به ویژه پزشکی هسته ای کاربرد تحقیقاتی و روزمره فراوانی دارد و دستگاه متداولی که این روش را جهت تصویر برداری به کار میبرد ، پت اسکن نامیده میشود.
دستگاه پت اسکن متشکل از چندین جفت آشکار ساز کوچک است که به صورت انطباقی پـرتـوهـای گـامـای تـولیـد شده از نابودی جفتی الـکتـرون و پـوزیتـرون را از درون بـدن بیمـاران آشکار میکند.
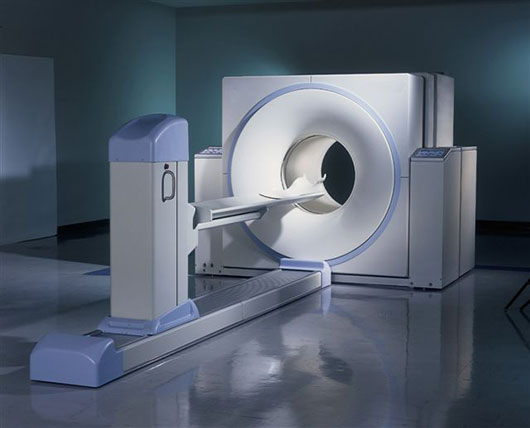
در دستگاه پت اسکن یک عنصر رادیواکتیو با نیمه عمر کوتاه که با گرفتن پوزیترون متلاشی مـیشـود (بـه لـحـاظ شیمـیایی مولکول فـعـال متابولیک محسوب میشود) به بدن بیمار تزریق مـیشـود و پس از وقفه کوتاهی (جهت پخش مـواد در سـیـسـتـم گـردش بــدن) بـیـمــار جـهـت تصویربرداری به داخل دستگاه پت اسکن منتقل میشود. مولکولی که بــدیـن مـنـظــور اسـتـفـاده مـیشـود ، فلوئورو دی اکسی گلوکز نام دارد.
امـروزه دسـتـگـاه هـای پــت در بـیـمـارسـتـانهـا ، در آشـکارسازی و تـحـقیقات در زمینه هایی همچون نـاراحـتی های مغز و اعصاب مثل روان گـسـیـخـتـگـی ، پـارکـیـنـسـون ، آلزایمر و آنکولوژی کاربرد وسیع دارند.
اخیــراً ایـن دسـتـگـاه بـا سی تـی اسکن یا ام آر آی به صورت ترکیبی و به نام PET/CT وارد بازار شده است.

تکنولوژی پت سی تی دو تکنولوژی بزرگ پت و سی تی اسکن را با هم ترکیب کرده تا بتواند اطلاعات لازم را در زمینه عملکرد سلول های سرطانی بدن به دست آورد. در بسیاری از مواقع پـزشـکـان بـا سی تـی اسکن یا ام آر آی و آزمـایـشهـای دیگـر توان تشخیص سرطان در بدن بیمار را ندارند اما با ادغام این دو اسکن ، پـزشکان میتواند اطلاعات کاملی را در مورد محـل ، انـداره ، نحـوه رشد و وسعت سرطان به دست آورند.
این دستگاه همچنین قابلیت نمایشی دیگری هـم دارد و میتوان در موارد دیگری هم از آن استفاده کرد. برای مثال میتوان مراحل پیشرفت در شیمـی درمـانـی را نـشان دهـد و همچنیـن میتواند وجود و یا بازگشت مجدد سرطان را حـتـی در مـراحـل اولـیه شان تشخیص داد. این قابلیت میتواند در درمان سرطان بسیار مفید باشد.
جهت استفاده از پت سی تی اسکن نیاز به اف دی جی (پزشکی هسته ای) ترکیبی با گلوکوز است که به بدن بیمار تزریق میشود و این محلول عمری کمتر از 110 دقیقه دارد. ساخت این محلول نیازمند دستگاه پیشرفته دیگری به نام سیکلوترون است.
بیمار پس از تزریق اف دی جی در درون دستگاه قرار گرفته و متخصص مربوطه میتواند عمکرد بدن و فعالیت دقیق سلول های سرطانی را مورد ارزیابی قراردهد. درصورتی که قسمتی از بدن شامل سلول های فعال سرطانی باشد ، در مانیتور مربوطه به صورت توده های قرمز مشخص میشود.
دستگاه پت سی تی با استفاده حالت رادیواکتیو گلوکز برای عکس برداری استفاده میشود. این ماده با نام اف دی جی شناخته شده است و تنها نیمه عمرش 110 دقیقه است. انجام پت سی تی در کشور مالزی بسیار نادر است و این تنها به دلیل محدودیت در واردات اف دی جی است.
بـرای مـمکن سـاختن و استفـاده روزانه از دستگاه پت سی تی اسکن ، بیمارستانها دستگاهی با تکنولوژی بسیار بالا به نام سیکلوترون را فراهم کرده اند که قابلیت تولید اف دی جی را دارد. توسط اف دی جی و تزریق آن به بـدن بـیـمـاران مشـکـوک بـه سرطـان بـا قـابـلـیـتـی بـسیـار دقـیـق مـیتـوان بـه آسـانی انواع سرطان را تشخیص داد.
بزرگترین مزیت پت اسکن در مقایسه با MRI اسکن یا اشعه ایکس ، این است که میتواند عملکرد بدن بیمار را نسبت به آنچه به ظاهر سالم میآید نشان بدهد.

ماموگرافی به کمک I-CAD
تا کنون انجام آزمایش بافت های سینه به وسیله دستگاه ماموگرام بسیار ناراحت کننده و ناخوشایند بوده است. در استفاده از ماموگرام بیمار نیاز دارد تا حالت ناخوشایند و دردناکی را تجربه کند تا پزشک بتواند سینه را برای انجام درمان در دستگاه قرار دهد. علاوه بر آن ، دیدن وارد شدن سوزن دستگاه به داخل سینه برای بیمار بسیار ترسناک است. مخصوصاً وقتی از سوزن های بزرگ استفاده میشود.
استریوتاکتیک بیوپسی پستان در بیمارستان که به دستگاه بافت برداری سینه و با نام ای بی بی آی شناخته شده است. سیستم ای بی بی آی توانایی شکاف بسیار کوچک در سرطان های ساکن یا مهاجم را در سینه دارد. با این روش میتوان حجم بزرگی از بافتهای سرطانی را (5 تا 20 میلی متر) از بین ببرد ، بنابراین درمان با دقت بالاتری انجام میگیرد. محل قرار گرفتن سینه میتواند در سه بعد مختلف عمل کند ، این به بیمار کمک میکند تا در حالت راحت تری قرار بگیرد. بافت برداری میتواند در حالت درازکش بیمار هم انجام شود ، به صورتی که سینه به سمت پایین بوده و در این حالت بافت برداری خارج از دید بیمار خواهد بود. در این روش بیمار حداقل ناراحتی را تجربه کرده و معمولا پس از پایان بافت برداری میتواند فعالیت روزانه خود را دنبال کند.
64 - Multi Slice CT Scan
دستگاه مالتی اسلایس سی تی دقت 0/4 میلی متر ، سرعت 0/33 ثانیه در هر 64 قطعه و تنها 8 ثانیه زمان اسکن دارد. متوسط زمان مورد نیاز برای هر بیمار برای اسکن فقط 10 دقیقه است.
دقت و شفافیت بالا در اسکن به پزشک این قدرت را میدهد تا بیماری هایی همچون سرطان را در مراحل اولیه و بسیار کوچک خود تشخیص دهد. سرعت بالای دستگاه در اسکن کردن این قابلیت را به آن میدهد تا تومورهایی همچون هپاتوماس (که به سرعت جذب مواد حاجب میشود) را تشخیص دهد. میتوان گفت توانایی های دستگاه 64 ام اس سی تی اسکن فراتر از غده شناسی است. برای مثال ، میتوان در مکان کرونری آنژوگرافی در بعضی از بیماران استفاده شود. (در این صورت دیگر نیازی به سونداژ نیست) و همچنیـن بـرای انجـام کـولـونـوسکـوپـی مجـازی (بـدون نیـاز بـه وارد کـردن آندوسکوپ) نیز کاربرد دارد.
روش (Intensity-Modulated Radiation Therapy (IMRT
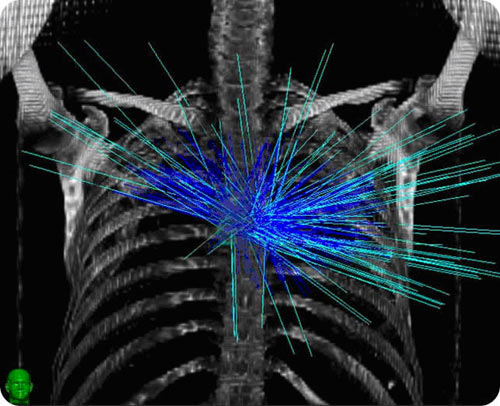
IMRT یک روش پیشرفته و پر دقت پرتو درمانی است که از کنترلگرهای کامپیوتری اشعه X در آن استفاده میشود تا تومورهای بدخیم یا نقاطی مشخص از تومور با دزی دقیق و حساب شده مورد تابش قرار گیرند. دز تابشی از سه بعد فضا به صورت منسجم در آمده تا اینکه به وسیله تلفیق یا کنترل شدت ، این پرتوها کانونی شوند تا بیشترین دز تابشی به تومور و کمترین مقدار آن به بافت های معمولی اطراف تومور تابانده شود. درمان دقیق با استفاده از عکسبرداری مقطعی (Tomography) که به وسیله عکس های CT به دست آمده صورت میگیرد. سپس با کامپیوتر بررسی شده تا مقدار مناسب دز تابشی محاسبه شود که بهترین و بیشترین اثر را بر روی تومور داشته باشد. معمولا ترکیبی از میدان های متعددی که بشدت تلفیق شده اند و از منابع پرتوی مختلفی منتشر میشوند و دارای دز مناسبی هستند به تومور تابانده میشوند.
به دلیل اینکه نسبت دز دریافتی توسط بافت معمولی به دز دریافتی تومور در IMRT به حداقل مقدار خود رسید ، بیشترین اثر دز تابشی میتواند به تومور برسد که در مقایسه با پرتو درمانی های مرسوم کمترین عوارض جانبی را خواهد داشت. همچنین IMRT قابلیت کاهش مسمومیت ناشی از درمان را تا وقتی که دز تابشی بالا نرفته را داراست. هم اکنون IMRT در درمان سرطان های زیر موفق است:
سرطان پروستات ، سر و گردن ، سینه ، ریه ، تیروئید ، کبد ، مغز ، غدد لنفاوی ، بیماری زنان و بافت های پیوندی. IMRT همچنین برای درمان سرطان های کودکان مفید است.
پرتو درمانی مبتنی بر IMRT رشد و تقسیم سلول های سرطانی را متوقف میکند ، بنابراین رشد تومور کند میشود. در بسیاری موارد ، پرتودرمانی باید توانایی کشتن سلول های سرطانی را داشته باشد تا تومور سرطانی را کوچک کند یا از بین ببرد.
یک شتابدهنده خطی پزشکی ، فوتونها یا اشعه X مورد استفاده در IMRT را تولید میکند. این دستگاه به اندازه یک اتاق کوچک است. بیمار روی تخت دستگاه دراز میکشد و دستگاه شتاب دهنده خطی ، پرتوها را از جهات مختلف به تومور میتاباند. شدت هر کدام از پرتوها در جهت های مختلف ، بسته به نوع طرح درمانی میتواند متفاوت باشد.
رادیوتراپیست در یک اتاق مجاور که در برابر پرتوها حفاظت شده است ، این کار را انجام میدهد. رادیوتراپیست میتواند در سرتاسر این پروسه با بیمار ارتباط داشته باشد. همچنین او میتواند بیمار را از طریق پنجره ای با شیشههای قطور (همراه با مولکول های سرب) یا از طریق مانیتور مشاهده کند.
قبل از انجام این روش ، سلامت فیزیکی بدن و سوابق پزشکی بیمار باید مورد بررسی قرار گیرد. سپس جلسه شبیه سازی درمان که شـامـل CT Scan مـیشـود ، از طرف متخصص سرطان انجام میگیرد که در آن شکل سه بعدی تومور و بافت های اطراف آن به دست میآید. متخصص دزیمتری و فیزیکدان پرتو پزشک از این اطلاعات استفاده کرده تا پرتوی مناسب را از IMRT اسـتـخـراج کـنـنـد. روش هـای اضــافی عکسبرداری میتواند شامل PET و MRI شود که ممکن است برای IMRT مورد نیاز باشد. این عـکـسبـرداری هـای تـشـخـیـصـی بـه مـتخصص سـرطـان کـمـک میکند تا مکان دقیق تومور را شناسایی کند. معمولا جلسات IMRT در حدود یک هفته بعد از شبیه سازی شروع میشود. در برخی موارد جلسه تدارک درمان ضروری است تا یک دستگاه ویژه قالب ریزی شود تا بیمار به راحتی و با دقت مورد درمان قرار گیرد. قبل از درمــان ، مـمـکــن اسـت پـوسـت بـیـمـار عـلامـت گـذاری یـا خـالکـوبـی شود تا هدفگیری درمان دقیق تر شود.
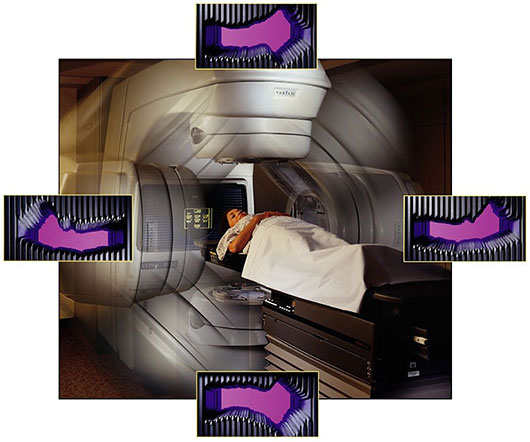
IMRT یـک درمـان تهـاجمـی اسـت که نیاز به جلسات متعدد و مجزای درمانی دارد. عوامل متعددی در تعیین تعداد جلسات IMRT نقش ایفا میکنند. متخصص سرطان نوع و مکان و اندازه تومور بدخیم را بررسی میکند. معمولا بیمارها برای پنج جلسه در هفته و به مدت شش هفته ، برای درمان IMRT نوبت دهی میشوند.
در آغاز جلسه ، بیمار توسط رادیوتراپیست روی تخـت خـوابـانـده مـیشـود و روی بدن او علامت گذاری میشود. ممکن است بیمار در حین درمان تغییر مکان داده شود. طول هر جلسه درمان نیز حدود 15 تا 30 دقیقه است.
مزایای IMRT
IMRT کنترل موضعی را بهبود میدهد و در همـان حـال نـیـز پــرتـودهی جـانـبی را روی بافتهای دیگر کاهش میدهد. IMRT همچنین برای برخی انواع سرطان سینه مفید اسـت ، مخصـوصـاً سرطان سینه چپ که روش های دیگر عوارض جانبی را به قلب متحمل میکنند. مطالعات قبلی نشان میدهد که پرتو دهی قلب میتواند اثراتی را از 10 تا 50 سال بر روی بیمار باقی بگذارد. IMRT اثرات پرتو دهی ناخواسته روی قلب را کاهش میدهد. مطالعات بر روی این مطلب هنوز ادامه دارد. IMRT بدون درد است. انسان چیز غیرعادی را احساس نمی کند. به هر حال در صورت ناراحت کننده بودن ، دستگاه را میتوان متوقف کرد. در هنگام انجام IMRT بیمار ممکن است اثرات جانبی درمـان را تجـربـه کنـد. حقیقـت انکار ناپذیر اثرات جانبی ، به ساختار بافت های معمولی مورد تابش قرار گرفته ارتباط دارد.
بهبود روشهای تصویربرداری در تشخیص سرطان
روشهای تصویربرداری فعلی که بــرای تـشـخـیـص بیمـاریهـا بـه ویـژه سـرطـان اسـتـفـاده مـیشـونـد ، تـوانایی تشخیص بیماری را در مراحل ابتدایی نــدارنـد. فـنــاوری نـانـو بـا اسـتـفـاده از نـانـوذرات مـغـنـاطــیـسی امکـان تـصـویـربرداری زود هنگـام از سلولهای سرطانی را فراهم آورده اسـت. هـمـچنین از این روش میتوان برای تصویربرداری سلولهایی که در برخی بیماریهای مغزی دچار تغییر میشوند نیز استفاده کرد.
در مراحل اولیه بیماری معمولا در سلولها تغییرات مولکولی ایجاد میشود که در مواردی نیز با تغییرات ژنتیکی همراه است. این تغییـرات با استفاده از نانوذرات مغناطیسی ، به عنـوان عـوامل ایجاد کنتراست تصویربرداری ، قــابـل تشخیـص هستنـد. اگـر ایـن نـانـوذرات بـا مـولـکـولهـای حـیـاتـی تـرکـیب شوند ، میتوان آنها را به محل دقیق تومور یا بافت ضایعه دیده رسـانـد. ایـن امـر مـوجـب مـیشـود که بتوان در مــراحـل ابـتـدایـی بـیـمـاری از بـافـتهـای هـدف کـه درگـیـر بــیـمـاری هـسـتـنـد ، تصویربرداری کرد. با ذکر این نکته که شناسایی با حساسیت بـسیار بالا و با مقدار کم مواد تزریقی صورت میگیرد.
ذرات مورد استفاده در این پروژه ، نانوذرات اکسیدآهن با انـدازهای زیـر 10 نـانـومـتـر و با پـوشـش سـازگار با بدن انسان هستند که در دستگاه های MRI مـورد اسـتفاده قرار میگیرند. این ذرات سوپر پارامغناطیس هستند و با مقادیر بسیار اندک میتوانند تصاویر بسیار شفاف و مناسبی از تغییرات ایجاد کنند. با توجه به این که این نانو ذرات قابلیت اتصال به بـیـومـولـکولهای اختصاصی برخی بیماریها (به ویژه تومورها) را دارند ، میتوانند به صورت هـدفدار بـه سـلـولهـای صـدمـه دیـده بـرسـند. دستگاه های MRI موجود توان تصویربرداری با ایـن روش تـشخیصی را دارند اما نیازمند سنتز نــانــوذرات سـوپــر پـارامـغـنـاطـیـس اکـسـیـدآهن هستند. سنتز این مواد ، عاملدار کردن شیمیایی آن ها ، ساخت آنتی بادیها و بیومولکولهای اختصـاصـی هـدفدار و در نهـایـت اتصـال ایـن نـانـوذرات بـه مـولـکـولهای هدفدار مراحلی هـسـتـنـد که در این پژوهش انجام شدهاند. این نانوذرات در حال حاضر بر روی حیوانات بدون سیستم ایمنی در حال بررسی و آزمایش هستند.
منبع: ماهنامه مهندسی پزشکی
کلمات کلیدی: biomedical engineering ، مهندسی پزشکی ، آشنایی با مهندسی پزشکی ، معرفی مهندسی پزشکی ، مهندسی پزشکی گرایش بالینی ، مهندسی پزشکی گرایش بیومکانیک ، مهندسی پزشکی گرایش بیوالکتریک ، مهندسی پزشکی گرایش بیومتریال (بیومواد) ، مهندسی پزشکی ایران ، مهندسی پزشکی دانشگاه پیام نور ، پایگاه آموزشی و اطلاع رسانی مهندسی پزشکی ، اخبار و تازه های مهندسی پزشکی ، مقالات مهندسی پزشکی ، آموزش مهندسی پزشکی ، دانلود کتاب های مهندسی پزشکی ، دانلود جزوه های مهندسی پزشکی ، دانلود نمونه سوالات امتحانی مهندسی پزشکی ، سایبرنایف ، پرتودرمانی ، Radiation Therapy ، رادیوتراپی ، درمان سرطان ، رادیوسرجری ، پزشکی هسته ای ، گامانایف ، پت سی تی اسکن ، تشخیص سرطان


.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)